诱导性多能干细胞
作者:admin 2021-02-21 阅读:2713 来源:本站
什么是诱导性多能干细胞
诱导性多能干细胞IPSC全称为 induced pluripotent stem cells, 是通过人工诱导非多能性细胞表达某种特定基因得到的。2006年日本京都大学Shinya Yamanaka在世界著名学术杂志《细胞》上率先报道了诱导多能干细胞的研究。他们把Oct3/4,Sox2、c-Myc和Klf4这四种转录因子基因克隆入病毒载体,然后引入小鼠成纤维细胞,发现可诱导其发生转化产生一种新细胞,即诱导多能干细胞iPS。

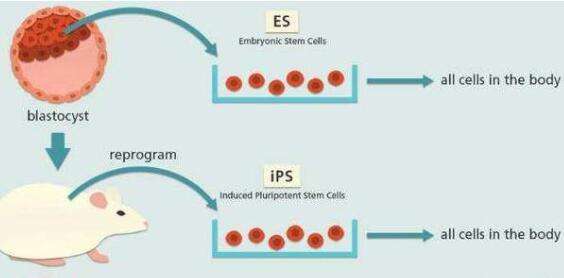
该细胞在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形瘤生成能力、分化能力等方面都与胚胎干细胞相似。也就是说,诱导多能干细胞(iPS细胞或iPSC),就是日本科学家山中伸弥在2006年利用病毒载体进行转录因子组合而形成的、具有超强分化能力的一种多能干细胞。
诱导性多能干细胞IPSC的来源
诱导多能干细胞与干细胞的最大区别就在于,他并非是直接来源于人体器官和组织,而是一种通过基因编辑而来的干细胞。例如首次发现它的山中伸弥,便是利用病毒载体将四个转录因子(Oct4, Sox2, Klf4 和c-Myc)的组合转入分化的体细胞中,使其重编程而得到的类似胚胎干细胞的诱导性多能干细胞。而世界各地不同科学家陆续发现其它方法同样也可以制造这种细胞,只需要根据其类型,选择相应的制备方式。
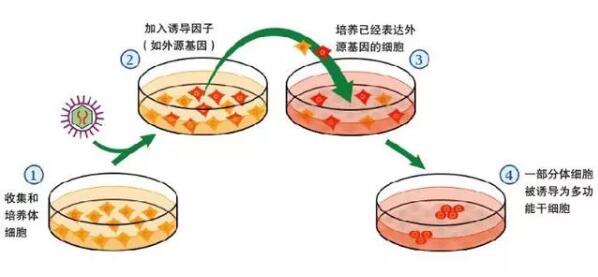
诱导多能干细胞IPSC的医学价值
诱导多能干细胞与其他来源于人体的干细胞一样,具有超强的分化再生能力、且免疫原性低。在再生医学、筛选和开发新药领域应用广泛。
再生医学
诱导多能干细胞同样具有超强的分化能力,能够分化成为人体各个器官和组织所需的不同类型的细胞,这对于器官再生有着重要意义。
新药开发
在开发新药时,研究人员可以使用培养的干细胞来测试药物的效用,了解药物治疗的可能性,这对研究人员新药研发的助力是不可预估的。
诱导性多能干细胞IPSC的优势
①诱导多能干细胞类似于胚胎干细胞,具有强大的分化再生能力,可以分化成人体各个器官和组织所需要的各种细胞类型。
②诱导多能干细胞是通过遗传编辑而来的一种干细胞,因此在来源方面不存在社会伦理问题。
③诱导多能干细胞可以通过基因编辑技术产生同基因对照细胞系,从而改变DNA达到治疗人类疾病的目标。
诱导多能干细胞的最新科技成果
1、由Cynata Therapeutics利用iPSC衍生的治疗产品领导的一项正式临床试验现在正在英国和澳大利亚进入II期临床试验。
2、在骨关节炎的干细胞治疗方面,澳大利亚干细胞公司Cynata完成了世界上第一个基于iPSC的I期试验。

3、日本,在进行许多以医生为主导的研究,以探索使用iPSC衍生的治疗产品治疗年龄相关性黄斑变性(失明)、帕金森病和心脏病等疾病。
4、同时,日本还有一项涉及生产诱导多能干细胞衍生血小板的研究也在进行中。
诱导多能干细胞IPSC技术编年史
2000年
Prof. Shinya Yamanaka在EMBO JOURNAL上发表了一篇文章,题为“NAT1/p97/DAP5在胚胎分化和维甲酸通路的重要作用”,报道了一种特异性蛋白在胚胎细胞分化中的作用,为他后来的研究奠定了基石。
2006年
Yamanaka发现了引入四个转录因子基因到小鼠成纤维细胞中,能够使小鼠细胞像胚胎干细胞那样重编程成为多能干细胞。该结果在Cell上发表,题为“通过特定因子从小鼠胚胎细胞和成年成纤维细胞中诱导多能干细胞”。既然iPSC来自患者的组织,该方法就有望避免使用胚胎细胞带来的争议和安全问题。
2007年
Yamanaka of Kyoto University of Japan和James Thomson of the University of Wisconsin Madison成功诱导出人iPSC,结果分别发表在Cell和Science上。Yamanaka发表的文章题为“通过特定因子从人成年成纤维细胞中诱导多能干细胞” Thomson发表的文章题为“从人类体细胞中诱导多能干细胞系”。
2008年
Yamanaka成立了iPSCs Research Center of Kyoto University。接下来的两年里,该研究中心并入Kyoto University(CiRA)研究应用中心。接着,CiRA开展了许多临床研究。
2012年
Shinya Yamanaka被授予诺贝尔生理学或医学奖,表彰他关于细胞能重编程为iPSC的发现,在CiRA中对iPSC研究的领导,以及他致力于将该技术应用于许多疾病和损伤治疗中做出的贡献。接着,日本政府附属研究所RIKEN发育生物学中心的一名研究人员Masayo Takahashi积极地将重点转移到iPSC上,并和Yamanaka达成年龄相关黄斑变性(AMD)治疗的合作协议。
2012年
Shinya Yamanaka被授予诺贝尔生理学或医学奖,表彰他关于细胞能重编程为iPSC的发现,在CiRA中对iPSC研究的领导,以及他致力于将该技术应用于许多疾病和损伤治疗中做出的贡献。接着,日本政府附属研究所RIKEN发育生物学中心的一名研究人员Masayo Takahashi积极地将重点转移到iPSC上,并和Yamanaka达成年龄相关黄斑变性(AMD)治疗的合作协议。
2013年
Masayo Takahashi开展了大鼠和猴初步试验后,向MHLW申请了临床试验。日本管理部门批准了课题组将iPSC用于视网膜再生的临床研究。另外,日本文部省(MEXT)未来十年决定资助iPSC研究所200-300亿日元(约合2-3千万美元)。原则上,政府资助科研不超过5年,所以这项协议是史无前例的。
2014年
Takahashi课题组从患者皮肤获取细胞并诱导为iPSC,然后培养成视网膜色素上皮细胞层(RPE),并移植到一位70岁AMD女性患者的右眼。这是世界上首例iPSC移植。自从批准了Takahashi的研究后,日本管理部门迫切期待这项技术尽快成功地进入临床实践,他们为了配合iPSC临床试验而修改了法规。
2014年11月
MHLW通过了一项再生医学的新法案,名为药物治疗和医疗器械法(PMA法),不仅简化了再生医学产品和早期产品的审查程序,而且改变了实施干细胞临床试验的准入条件。这项法律为细胞治疗打开了绿色通道,只要能证实产品的安全性和可预期的有效性,主管部门就会授予许可,推动后续临床试验的有效性评估。基于此,批准再生医学药物的周期被显著缩短了,从以往的七年缩短到二至三年。这个速度甚至领先于欧洲和美国。无论如何,关于日本体系也存在争议。有些人认为这会导致孤注一掷的患者被迫采取无效的治疗。
2014年
Yamanaka发表的文章中的电泳结果被质疑,文章发表在2000年的EMBO JOURNAL,题为“NAT1/p97/DAP5在胚胎分化和维甲酸通路的必要作用”,结果中经过不同方式处理的两组样本的误差非比寻常地一致,而且电泳结果过于相似。Kyoto University声明已调查研究结果,但研究的结论没有任何问题。Yamanaka承认说,能证实他实验数据的记录已经丢失。Yamanaka说尽管他有那篇文章的实验数据,但他没有保存他同事持有的实验数据。他对这件事感到愧疚并为他的失职向公众道歉。
2014年
RIKEN的Haruko Obokata发现了一种新方法,能使小鼠的普通成熟细胞获得胚胎干细胞的能力,能变成各种各样的细胞。他们把该技术命名为刺激触发的多能性获取(STAP),并在Nature同一天发表了两篇文章,题为“刺激触发的从体细胞到多能性细胞的命运改变”和“获得性多能性的重编程细胞的双向发育潜能”但是,在发表五个月后,文章被认定学术不端并被撤销。Sasai Yoshik、她的导师和并列作者自杀了。这个悲剧在学术界引起轰动并给iPSC发展敲响了警钟。
2015年
CiRA和Takeda Pharmaceutical Company Limited(Takeda),一个基于科研致力于制药的跨国公司,宣布他们将共同合作开发iPSC在很多难治性疾病中的临床应用。“Takeda-CiRA iPSC细胞应用联合项目”(T-CiRA)旨在推进多项研究项目,发现新药,并将iPSC技术应用于细胞治疗领域。CiRA的主任Yamanaka指导该项目,Takeda提供长期资金。
2015年
Takahashi课题组宣布中止AMD实验,该实验部分发表于Nature Biotechnol,题为“RIKEN中止了涉及诱导性多能干细胞的第一个临床试验”。[9] 首先,第二例患者的iPSC培养分析显示有六个基因突变,包括一个癌症相关基因。其次,研究人员提议不再使用自体iPSC,转而使用同种异体iPSC,因为动物实验证实使用同种异体iPSC不会导致免疫排斥。他们需要更长时间申请这项技术的临床应用。这个临床试验中止后,有一场关于iPSC前景的激烈讨论。鼓舞人心的是,同种异体iPSC实验在2016年重启。
2016年
Yamanaka在Proc Natl Acad Sci USA期刊上发表了文章,题为“Natl能促进诱导小鼠胚胎干细胞分化的特异性蛋白的翻译”,报道了一个惊人的研究结果,NAT1 (eIF4G2)基因能使iPSC从盛年期返回幼稚期,替代了之前使用的四个基因(Oct4, Sox2, Klf4 and c-Myc)。
2016年
Bayer and Versant Ventures B联合成立并启动BlueRock Therapeutics公司。该新生代再生医学技术公司计划使用工业引领的平台发展出最佳的iPSC疗法,治愈一系列疾病。值得注意的是,整个方法的基础是Yamanaka的iPSC技术的知识产权(IP),由iPS Academia Japan Inc.管理相应的IP。这个基础性IP将允许该公司制造关键细胞来源--iPSC。
2017年
两篇iPSC治疗AMD临床试验的文章同时发表在NEJM,但他们的结果不一致。一篇是2014年世界首例iPSC移植,用iPSC治疗AMD。Takahashi发表了详细的研究过程和两年随访结果,证明iPSC在人体安全。 然而,另一篇文章描述了US stem cell Inc.(旧称 Bioheart)开展的失败的临床试验,题为“玻璃体内注射同源干细胞后视力丧失”。在FDA批准下,患者接受了玻璃体内同源脂肪组织来源的iPSC。但是在一年随访期间,两名患者的情况迅速恶化,一名患者永久性失明。这个失败提醒我们医生需要负责这样的临床实践并教育患者,管理部门对保护患者和推动恰当的研究创新至为重要。
2017年
RIKEN与CiRA、Kobe Municipal Medical Center central Citizen Hospital和Osaka University合作移植同种异体iPSC来源的视网膜细胞到一位60岁AMD男性患者右眼。这是世界首例同种异体iPSC移植。使用他人iPSC细胞可显著减少临床研究的花费和准备移植所需的时间。
2018年1月
Takahashi课题组宣布在一项使用同种异体iPSC治疗AMD的临床试验中,一名70岁男性视网膜发生水肿,术后4个月切除视网膜。2019年4月进一步报道该病例的发生原因是手术后并发症,和iPSC特性无关。2017年3月至9月间,他们已经对五名AMD男性患者实施了单眼视网膜细胞移植。移植的视网膜细胞培养自同种异体iPSC。目前,这项临床研究的安全性已被确认,在受试者中没有发生明显的排斥和副作用。研究人员说,这项临床研究的目的已经达到,使用iPSC的安全性已被确认,未来会实施新的临床研究来提高移植效果。
2018年
Osaka University心血管系Prof. Yoshiki Sawa使用iPSC产生心肌细胞,用于心脏治疗。这个项目由Japan Agency for Medical Research and Development(AMED)指导实施。同时,他们制作了足够数量的安全的心脏细胞片,用于人类移植。随着研究的进展,实验室计划进入临床试验阶段,并向Osaka University再生医学委员会申请批准。他们把用同种异体iPSC制成的两个环形细胞切片粘到患者心脏表面。这些细胞分泌蛋白质和其他物质,提高心脏功能。每层厚0.05 mm,直径数厘米。这项应用直到2020年1月才实施(见封面故事)。
2018年
MHLW批准了CiRA的Prof.Eto Koji实施一项临床试验计划,使用患者的iPSC生产具有止血功能的血小板,治疗重型再生障碍性贫血。这是第一个使用血细胞来源的iPSC的临床试验。课题组已经建立了一种用iPSC大规模生产优质血小板的方法。他们计划分三次输入,逐渐增加血小板数目,最后一轮达到1千亿个。而且,由Eto Koji参与创建的Megakaryon Co., Ltd正在研究使用同种异体iPSC制备输血用血小板,以缓解血小板供应不足的难题。课题组观察了小鼠的反应,并发现了骨髓和血管的湍流活化了血小板生成。同时,课题组研制了一个垂直培养仪,可以在体内及体外重新制造湍流。这些结果发表在Cell,题为“湍流活化血小板生物生成过程,使得临床规模的离体制造成为可能”。
2018年
Takahashi在Nature发表了一篇文章,题为“在灵长类帕金森病模型中的人类iPS细胞产生的多巴胺能神经元功能”。Takahashi课题组在使用iPSC治疗人帕金森病的临床试验中获得成功,这是世界首例在帕金森病患者中进行的移植手术。此前,iPSC移植的潜在风险,比如癌症,已经在灵长类帕金森病动物模型中仔细观察并排除。iPSC移植的安全性和有效性已被确定。基于此,MHLW批准了该研究。患者的恢复情况良好;而手术的有效性和安全性仍需长期观察。根据该项目计划,该临床试验将为七名患者实施移植。
2018年
MHLW批准了一项用患者自体干细胞治疗脊髓损伤(SCI)的再生医学产品治疗计划,发表在Stem Cell Reports,题为“γ分泌酶抑制剂能促进使用人类iPSC来源移植物的慢性脊髓损伤患者的功能恢复”该细胞由Sapporo Medical University的Prof. Osamu Honmou和NIPRO制备,后者是一家著名的医疗器械公司。他们首先提取了患者的脑脊液,分离iPSC,并使用成骨组织和血管组织在体外培养iPSC。通过给SCI患者静脉输液,细胞自动聚集在注射部位,并且通过抑制炎症、促进神经再生或分化成神经细胞,起到修复作用。
2019年2月
MHLW批准了一项应用同种异体iPS治疗SCI的研究,该研究由Hideyuki Okano from Keio University领导,在Regen Ther发表了题为“使用诱导性多能干细胞对脊髓损伤患者进行细胞治疗”的文章。[16] 在该治疗中,研究人员将CIRA的iPSC转化为以神经细胞为基础的细胞,作为同种异体医学用途。他们会移植大约2百万个新的神经细胞到患者的损伤部位。作为额外的预防手段,研究人员也将使用免疫抑制剂来预防对移植细胞的排斥反应。
2019年7月
MHLW批准了在角膜疾病中使用iPS移植,项目由一个Osaka University的课题组资助,由Koji Nishida领导。课题组实施了世界首例iPSC源人工角膜组织移植。他们为角膜疾病患者创造了一种新的治疗方法。用Kyoto University iPSCs研究所提供的iPSC,培养成角膜细胞,并制成厚约0.05 mm的膜组织,然后移植到患者眼内。移植的细胞将有望产生更多的角膜细胞,从而促进视力恢复。患者会被随访1年以确认移植的安全性和有效性。
2019年9月
Tokyo Medical and Dental University Prof. Takanori Takebe领导的课题组用人iPSC创造了世界首个微型多器官结构。他们在Science发表了文章[17],题为“类器官的设计”。这是继2013年Takebe宣布创造了微型肝以来的最新研究,此前Takebe在Nature发表了文章,题为“iPSC源器官芽移植后可生成有血管且有功能的人肝脏”。
据发表在British Journal for the Philosophy of Science (BJPS)电子版的文章报道,这个1 cm大的结构由微型肝脏、胰腺和胆管以及使胆汁经胆管从肝脏流出的多器官网络组成。研究人员已计划实施为重度肝病患者移植微型肝的临床研究。
2019年11月
由Kyoto University Prof. Noriyuki Tsumaki领导的课题组在Tissue Eng发表了一篇文章,题为“人诱导性多能干细胞源软骨的整合能力”。他们向MHLW申请将iPSC源软骨移植到损伤的膝关节,于2020年1月得到批准。他们用储存在CiRA的iPSC创造了直径为2-3 mm的软骨。课题组会随访患者直至术后一年。
总结
尽管有许多使用iPSC技术的临床试验,但期待在短期内实现临床应用是不现实的。
通常来说,把一项科学发现转化成临床和商业用途需要花大约20年,iPSC的应用也是一样。甚至今天,在发现iPSC十多年以后,研究人员对其中的运作机制仍不十分明确。对于任何iPSC疗法,找到合适的方法制造数量充足且纯度符合要求的合适的细胞类型需要花费数年。研究人员必须有耐心且持之以恒,同时还需要需要制药产业和政府的支持。
iPSC不是魔法,和任何新技术一样,应用到临床需要时间的积累。
Tips:
以上就是关于“诱导性多能干细胞”的全部内容。如果还有疑惑的话欢迎免费咨询诺和健康资讯分享平台的专业顾问。祝您好运~















 武汉市洪山区东湖高新生物城
武汉市洪山区东湖高新生物城

 联系我们
联系我们
